May 25, 2019 ページビュー:508
これまで、リチウム電池に完全に理想的な電解質はありません。今日最も一般的に使用されている有機電解質は、高いイオン伝導性と広い温度範囲です。発火しやすく安全事故の原因となるため、新しい電解質の開発が不可欠です。新しい電解質の開発には信頼できる理論が必要ですが、電解質にはより多くの影響因子(粘度、塩濃度、溶解、イオン会合、イオン-溶媒相互作用など)が含まれるため、イオンの移動メカニズムはあまり明確ではありません。では、リチウムイオンは有機電解質、固体電解質、イオン液体電解質でどのように移動するのでしょうか。
まず、有機電解質
電解質はリチウム電池内のキャリアとして機能し、正と負の材料間のイオン輸送のための輸送経路を提供します。帯電過程を例にとると、正極活物質からLi +が除去され、正極の固相粒子表面のLi +濃度が低下するため、の内部と表面で濃度差が生じる。 Li +が粒子を生成して、内側から外側に拡散するようにします。同時に、粒子表面の電気化学反応により生成されたLi +が電解質に入り、液相の界面領域の局所濃度が上昇し、液相内の濃度に差が生じ、拡散と移動が起こります。内側から外側へのLi +の。負極領域では、負極粒子が電解質中のLi +と電気化学的に反応するため、液相のLi +が消費され、液相のLi +濃度が低下し、濃度差が生じて拡散と移動が起こります。溶液相における外側から内側へのLi +の移動。
同時に、負極粒子の表面で電気化学反応が起こり、Li +が挿入されて粒子内部の濃度に差が生じ、Li +が粒子の外側から内側に拡散します。セパレータでは、正極と負極による濃度差により、この領域のLi +が正極から負極への拡散と移動を引き起こし、放電プロセスは上記のプロセスとは逆になります。上記のプロセスから、リチウム電池の正常で効率的な動作は、主に電池内のリチウムイオンの移動によって決定されることがわかります。リチウムイオンの移動は電解質の性質によって制限され、電解質の性質は主に以下の要因の影響を受けます。
1.リチウム塩の溶解
電解質は溶質と溶媒で構成されています。溶質は、一般に、複数の有機溶媒の組み合わせの液体から選択される。 LiPF6が溶媒に溶解すると、リチウムイオンとPF6負イオンが形成されます。リチウム塩の溶解度は溶媒の誘電率と密接に関係しており、誘電率が大きいほどリチウム塩の溶解度が高くなります。リチウムイオンが溶媒分子に完全に囲まれると、リチウムイオンに対する負イオンの影響が弱まり、いわゆる溶解が起こります。リチウム塩の場合、陰イオンが大きいほど、電解質のイオン伝導性とそれ自体の溶解が良くなります。陰イオンが大きいほど、負電荷を分散させやすくなり、陽イオンのペアリングを防ぐことができるからです。
2.電解質の粘度
電解質の粘度はイオンの動きに重要な影響を及ぼし、粘度が低いほどイオンの動きが良くなります。
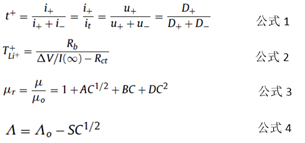
リチウムイオンは、電極液の溶解と粘度の影響下で輸送および移動します。式1では、t +は輸送の数、i +とi-はそれぞれ陽イオンと陰イオンによって形成される電流を表し、u±は陰イオンと陽イオンの移動度を表し、D±は陰イオンと陽イオンの拡散係数。
実際、イオン抵抗は陰イオンと陽イオンだけでなく、溶媒にも関係しています。イオン移動の数は、式2で表すことができます。
これらの中でも、TLI ++は、リチウムイオンの移動の数を表し、ΔVは、分極電圧であり、Iは(∞)分極後の定常電流であり、そしてRbおよびRCTは、バルク抵抗と電荷移動抵抗です。
単相溶媒系の電解質は、高導電率と低粘度の両方を持つことは困難です。したがって、一般的に使用される電解質溶媒は、二成分電解質などのさまざまな溶媒によって配合されます。 (リチウム塩)+(1-w)(溶媒A)+ w(溶媒B)、リチウム塩のm単位は一般にモル濃度、mol / kgであり、wは溶媒の質量分率です。単位電解質の場合、電解質の粘度とイオン伝導度を予測する信頼できる理論はありません。 Jones–Dole(JD)とDebye–Hückel–Onsager(DHO)は、式3と式4の2つの実験式を提案しました。
ここで、μrは相対粘度、μは溶液粘度、μ0は純粋な溶媒粘度、Cはリチウム塩濃度、A、B、Dは係数、Λはモル伝導率、Λ0はモル伝導率です。無限希釈状態。 Sは溶媒の物理的特性と電解質の特性に影響されるパラメータであり、Cは溶質の濃度です。リチウム塩や溶媒の種類が変わった場合は、実験式も変更する必要があります。混合電解質の場合、式はより複雑です。
したがって、新しい多成分電解質を構成する場合、電解質の性能をテストして決定する必要があり、事前推定を実行することはできません。イオン伝導性は電池の性能に大きな影響を与えますが、SEIの形成や性能などの他の要素も非常に重要な要素であり、高倍率での電解質の安定性や毒性なども考慮する必要があります。つまり、イオン伝導度パラメータを検討する前に、実際の製造アプリケーションに関連するすべての要因を考慮する必要があります。
第二に、固体電解質
固体電解質は、液体有機電解質と比較して、シンプルなデザイン、便利なパッケージング、優れた耐衝撃性と耐振動性、優れた耐熱性と耐熱性、電気化学的安定性と広い範囲、安全性など、リチウム電池にとって大きな利点があります。良いセックスなど。ただし、固体電解質のイオン伝導率は比較的制限されています。一般に、固体電解質は、ゲルポリマー、無溶媒ポリマー、無機結晶化合物、無機ガラス材料などに分類することができる。無機結晶化合物の内部では、リチウムイオンの伝導は、周囲の電位のエネルギーの好ましい部位間の可動イオンの移動によるものであり、周囲のイオンの動きは、移動するイオンに活性化エネルギーを提供して、それらを通過させる結晶構造のチャネル。
高分子電解質のイオン輸送メカニズムは、無機結晶化合物や液体電解質のイオン輸送メカニズムとは異なります。無溶媒ポリマー電解質では、イオン移動度はポリマーホスト材料の動きの影響を受けます。イオンは、ポリマーセグメントがガラス転移温度(Tg)に関連するかなりの振幅運動を受ける場合にのみ移動します。高分子電解質は、ガラス転移温度Tgよりも高い温度で速いイオン伝導性を示します。この場合、高分子電解質は主にアモルファス相で構成されます。そのため、PEO(Tg-50〜-57°C)などのガラス転移温度Tgが低いポリマーが無溶媒電解質の重要なポリマーホストになり、そのイオン性を高める方法としてポリマーのアモルファス化が研究されています。導電率。 。ゲルタイプのポリマー電解質は、ポリマー内の低分子量溶媒の拡散とポリマーセグメントの移動により、無溶媒電解質よりも速いイオン伝導を示します。
PEOを例にとると、このタイプのポリマーの電解質輸送メカニズムは上図のようになります。帯電後、ポリマーのアモルファス部分のセグメント運動は、Li +の「脱錯化-再結合」プロセスの反復プロセスにつながります。高速移行を実現します。
半導体産業で開発された薄膜技術ベースの固体電解質は、固体マイクロバッテリーの主要コンポーネントとして集中的に研究されてきました。マイクロバッテリー用に開発されたほとんどの結晶性およびガラス状電解質のコストは、合成時間が長く、製造プロセスの高温条件のために高すぎます。これらの欠点に加えて、固体電解質用の無機材料には通常、Ge、Ti、Sc、In、Lu、La、Yなどの高価な金属が含まれています。ゲルタイプのポリマー電解質は、増幅と適用が困難なため、商業的に成功しています。ほとんどの固体電解質。
第三に、イオン液体電解質
電解質と見なされる別のクラスの材料は、イオン液体です。イオン液体の定義は現在不明であり、一般に陽イオンと陰イオンのみで構成される液体と考えられており、室温または室温近くの液体有機塩である。イオン液体は、不燃性、低蒸気圧、高熱安定性、優れた電気化学的安定性、低毒性、高イオン含有量などの独自の特性を備えています。
一般に、イオン液体は、AlCl 3型イオン液体、非AlCl 3型イオン液体、特殊イオン液体の3種類に分類されます。さまざまなイオン液体の物理化学的特性は、関連する文献に記載されています。一般に、イオン液体の粘度は、液体電解質の粘度よりも1〜2桁高いため、イオン伝導度は、液体電解質のイオン伝導度よりも3〜4桁低くなります。 Waldenの法則は、イオン液体の導電率と粘度の関係に一般的に使用され、次のように表されます。
λiはイオン種iのイオン伝導度、μは粘度です。
粘度は主にファンデルワールス相互作用、立体配座の自由度、クーロン力、イオン形状などの影響の相互作用によって決定されるため、研究者はイオン液体中のイオン物質の相互作用を研究するために多大な努力を払ってきました。低いイオン伝導率に加えて、イオン液体電解質がカーボンアノード材料上にSEI層を形成する可能性は低く、循環するLiイオンが枯渇します。したがって、多くの場合、イオン液体は電解質として使用される添加剤を必要とします。
このページには、機械翻訳の内容が含まれています。
 伝言を残す
伝言を残す



すぐにご連絡いたします